L’elio, uno dei gas nobili, è inodore, insapore, incolore e ha un profilo unico quando si tratta di caratteristiche e comportamenti. È anche un gas molto speciale nel gruppo dei gas nobili per diversi motivi. Vale a dire, ha la più grande energia di ionizzazione di qualsiasi gas nobile.
Innanzitutto, è importante capire cos’è l’energia di ionizzazione e perché l’elio ne ha bisogno. Ogni elemento della tavola periodica ha un’energia di ionizzazione unica, misurata in kilojoule per mole.
Non solo ha la più grande ionizzazione; l’elio è il secondo elemento più abbondante nell’universo dopo l’idrogeno. Poiché è così abbondante, quasi il 25% dell’universo è costituito da elio! Gli atomi di elio sono così leggeri che hanno la capacità di sfuggire alla gravità terrestre, che è uno dei motivi per cui è un elemento così raro sulla Terra.
Articoli correlati
- Le api (miele) fanno la cacca? E Spiegazione Di Altre Funzioni Corporee
- Questo gatto domestico va in overdrive quando vede un gatto selvatico che li insegue
- Recensione delle mangiatoie per uccelli Kingsyard
- Zebù
- I cani possono mangiare i calamari?
Sai perché l’elio ha la più grande energia di ionizzazione? Continua a leggere per saperne di più sull’elio, l’energia di ionizzazione e perché l’elio ha la più grande energia di ionizzazione di qualsiasi elemento!
Il segreto dietro l’elevata energia di ionizzazione dell’elio
©Mike Price/Shutterstock.com
L’elio ha la più grande energia di ionizzazione tra tutti gli elementi a causa della sua struttura atomica. Con un solo guscio di elettroni al di fuori del suo nucleo, l’energia necessaria per ionizzare un elettrone lontano dal nucleo è la più alta della tavola periodica.
Perché? Innanzitutto, è importante comprendere l’energia di ionizzazione.
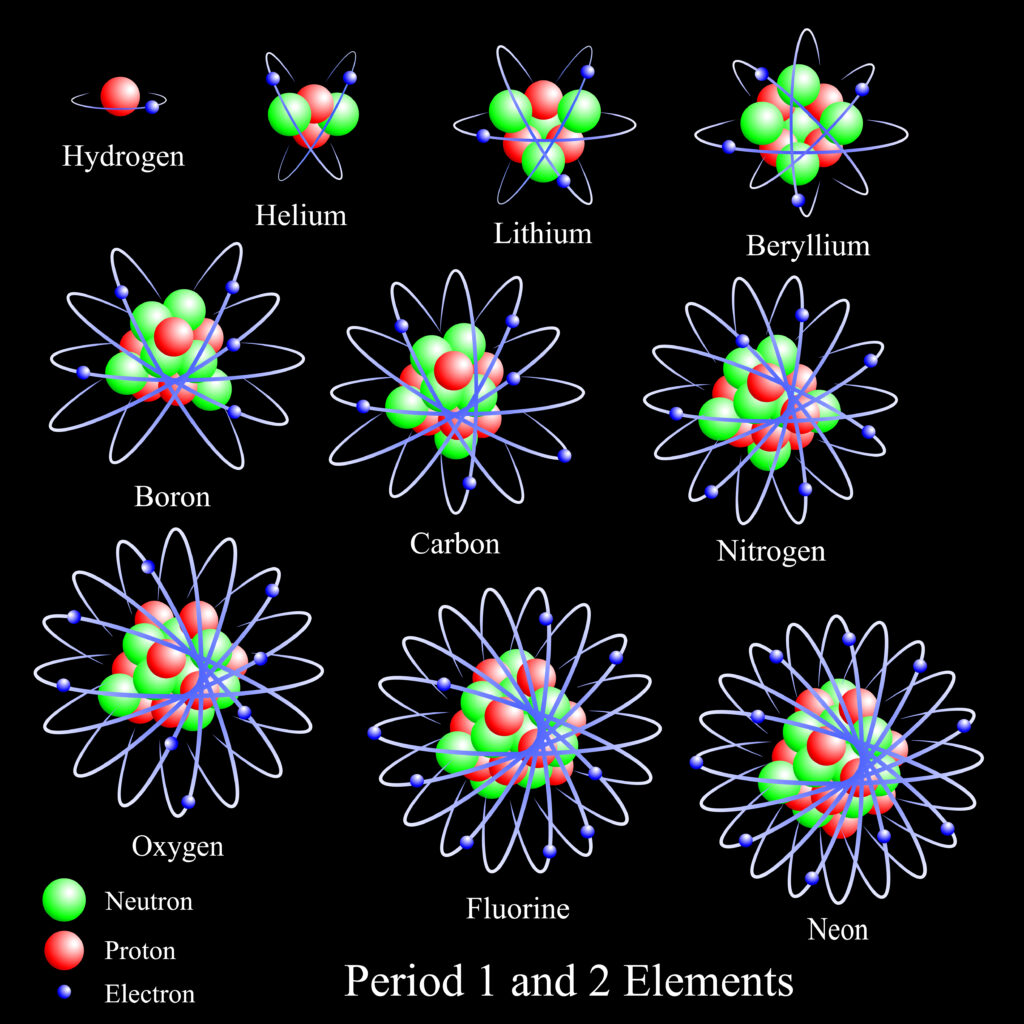
L’energia di ionizzazione di un atomo o di un elemento dipende dalla forza con cui il nucleo trattiene l’elettrone di valenza. Poiché l’elio ha un guscio di elettroni con i suoi soli due elettroni su di esso, ha una forte attrazione elettrostatica per i protoni caricati positivamente nel nucleo. In quanto tali, gli elettroni richiedono una notevole quantità di energia per allontanarsi completamente dall’atomo. Ecco perché l’elio ha la più grande energia di ionizzazione tra tutti gli elementi.
In generale, l’energia di ionizzazione tende ad aumentare mentre ci si sposta attraverso un periodo (riga) nella tavola periodica da sinistra a destra. Questo perché il numero di protoni nel nucleo aumenta, rendendo più forte l’attrazione tra il nucleo e gli elettroni, e quindi diventa più difficile rimuovere un elettrone.
Incontra l’elio: il gas speciale
Ora sai che l’elio è inodore, insapore e incolore, ma sapevi che è anche il secondo elemento illuminante della tavola periodica? Non solo, l’elio è l’unico elemento che non può essere solidificato raffreddandosi alla normale pressione atmosferica a cui tutti gli altri elementi possono solidificarsi! L’elio ha anche il punto di ebollizione più basso di qualsiasi altra sostanza conosciuta (-452,070 gradi Fahrenheit).
Sfortunatamente, l’elio è una risorsa naturale non rinnovabile. Ciò significa che una volta che gli esseri umani raccolgono tutto l’elio presente in natura nel mondo, dovranno trovare un modo artificiale per ricreare l’elemento. Texas, Oklahoma e Kansas hanno l’elio più abbondante attorno ai depositi di gas naturale.
Tra le altre proprietà interessanti dell’elio, ha un’elevata conduttività termica e inerzia, il che significa che l’elio può trasferire bene il calore e non reagisce prontamente con altri elementi in condizioni normali.
Rispetto agli altri gas della tavola periodica, l’elio si distingue per la sua struttura atomica. Ha due elettroni nel suo guscio esterno mentre il resto dei gas nobili ne ha otto. Ricorda che gli elettroni di valenza influenzano la capacità di un atomo di legarsi con un altro atomo, trasformando così qualcosa in un composto o elemento diverso. Pertanto, gli elettroni di valenza dell’elio contribuiscono alla sua elevata energia di ionizzazione.
Comprensione dell’energia di ionizzazione
Per definizione, la ionizzazione è il processo di carica negativa o positiva di un atomo. Come succede? Guadagna o perde un elettrone, che ha una carica negativa. Il prodotto risultante di questa variazione di carica elettrica è chiamato ione. Quindi, viene chiamata la creazione di uno ione ionizzazione.
Capire come si formano gli ioni aiuta a spiegare l’energia di ionizzazione. L’energia di ionizzazione descrive quanta energia richiede qualcosa per rimuovere un elettrone da un atomo o uno ione a qualcos’altro. Un altro modo di pensare all’energia di ionizzazione è quanto strettamente un atomo manterrà i suoi elettroni. Gli atomi con un’elevata energia di ionizzazione vogliono i loro elettroni e lavorano duramente per mantenerli. Gli atomi con bassa energia di ionizzazione cederanno prontamente i loro elettroni senza troppa resistenza.
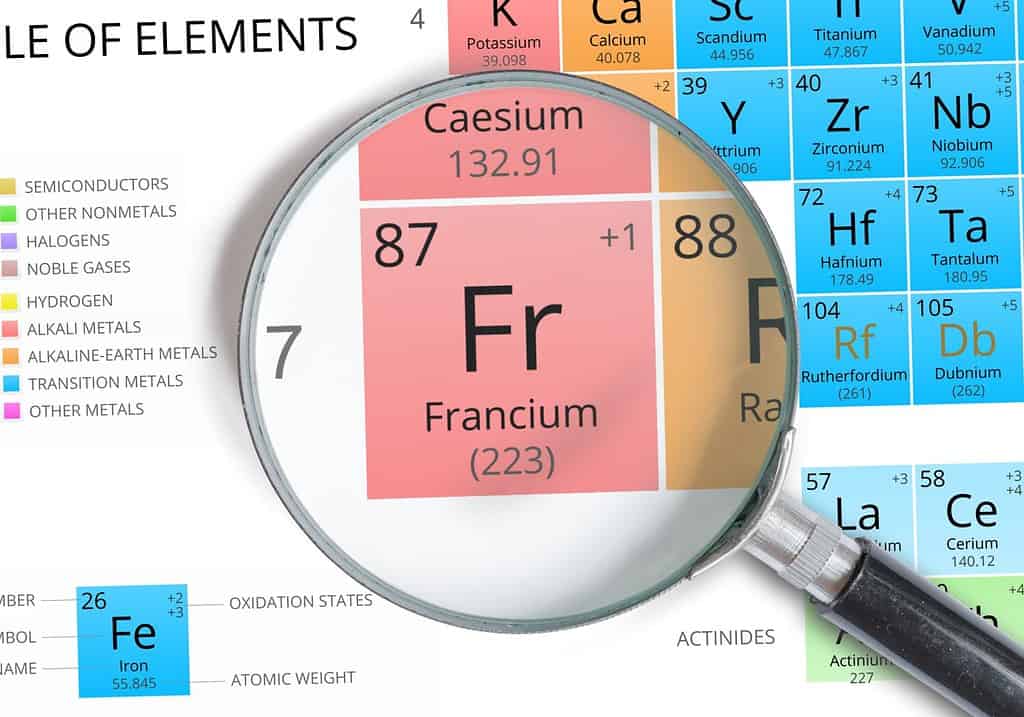
Qual è l’ordine dell’energia di ionizzazione?
©vchal/Shutterstock.com
La comprensione dell’ordine dell’energia di ionizzazione inizia dalla tavola periodica. In generale, la regola per l’energia di ionizzazione è: l’energia più alta è l’elemento più in alto, più a destra sul tavolo e il più basso è l’elemento più in basso, più a sinistra in base al numero di gusci di elettroni e di elettroni di valenza un elemento ha. Ciò rende l’elio la più alta energia di ionizzazione e il francio la più bassa.
Oltre a comprendere quanto facilmente gli elettroni possono essere rimossi dall’atomo, l’energia di ionizzazione offre a scienziati e ricercatori la capacità di sapere come un elemento può reagire o comportarsi. Ciò è particolarmente importante nella ricerca che combina o vuole testare le reazioni di due o più elementi.
L’energia di ionizzazione è direttamente correlata al numero di gusci di elettroni. Di norma, gli elementi con un numero maggiore di gusci hanno un’energia di ionizzazione inferiore perché il guscio esterno è molto lontano dal nucleo.
La configurazione elettronica dell’elio
Scoperto per la prima volta nel 1897, l’elettrone non ha componenti o sottoparticelle conosciute. In poche parole, è una particella elementare che funge da elemento costitutivo della materia.
Un atomo è costituito da diverse particelle subatomiche, una delle quali è un elettrone. Gli elettroni hanno una carica di elettricità negativa, si trovano in tutti gli atomi e permettono il processo di ionizzazione. Gli elettroni hanno la capacità unica di bilanciare la carica di un atomo contro la carica positiva dei protoni nel nucleo atomico.
La configurazione elettronica è un modo per descrivere la disposizione degli elettroni in un atomo. Implica l’uso di numeri e lettere per rappresentare quanti elettroni ci sono in ogni livello o “guscio” dell’atomo. La configurazione elettronica aiuta a capire come si comportano gli elettroni e perché alcuni elementi interagiscono con altri mentre altri no. Gli scienziati usano queste informazioni per studiare e comprendere le caratteristiche di vari atomi.
Applicazioni nella vita reale delle proprietà speciali dell’elio

©iStock.com/anyaberkut
L’elio è più spesso usato nei palloncini. Perché? Ebbene, le proprietà speciali dell’elio consentono ai palloncini di:
- Sii più leggero dell’aria.
- Non bruciare (come farebbe l’idrogeno).
- Da usare in sicurezza (non è tossico).
Oltre a gonfiare i palloni, l’elio viene utilizzato nei dirigibili e nei dirigibili e nei sistemi di raffreddamento. Sui dirigibili, l’elio funziona in modo simile a come viene utilizzato in un pallone. Poiché l’elio non è combustibile ed è più leggero dell’aria, ha una grande capacità di sollevamento e non brucia, il che potrebbe causare la morte di chiunque si trovi a bordo. La conduttività termica dell’elio lo rende un ottimo agente di raffreddamento perché non si solidifica a temperature estreme. Le macchine e la tecnologia che utilizzano agenti di raffreddamento ad elio includono strumenti satellitari, bobine di magneti superconduttori e altro ancora.
Infine, le dimensioni ridotte e la natura inerte dell’elio lo rendono un ottimo gas tracciante per rilevare perdite in vari sistemi, come tubazioni, container e unità di condizionamento dell’aria. Le miscele di elio-ossigeno, note come heliox, vengono utilizzate per le immersioni in acque profonde per ridurre il rischio di narcosi da azoto, una condizione causata da alti livelli di azoto nel sangue.
L’elio ha la più alta energia di ionizzazione sulla tavola periodica
L’elio ha la più grande energia di ionizzazione a causa della sua struttura atomica. Con i suoi elettroni esterni che si tengono così saldamente al centro, ci vuole un’enorme quantità di energia per rimuoverlo completamente dall’atomo su cui orbita.
Ora che hai una buona comprensione delle proprietà uniche dell’elio e perché ha la più grande energia di ionizzazione di tutti gli elementi, puoi saperne di più sul mondo.
Categoria: News



