Ammettiamolo, la chimica è uno dei campi accademici più difficili da padroneggiare. A volte può essere difficile anche capirne le basi! Uno dei motivi per cui è così impegnativo è che si tratta di materiale di cui non si parla spesso nella vita di tutti i giorni. Inoltre, molti di essi sono diversi e richiedono una buona memorizzazione e un lavoro concettuale per essere compresi.
Uno dei concetti più stimolanti sono i gruppi funzionali, che costituiscono la base di molte reazioni chimiche. Due gruppi che rappresentano particolarmente una sfida per gli studenti sono le ammine e le ammidi. Sebbene entrambi abbiano una componente di azoto simile, presentano differenze importanti che sono importanti per la loro chimica. Non preoccuparti se ti perdi le differenze tra loro. Oggi discuteremo del grande dibattito tra ammina e ammide.
Cosa sono le ammine?
Le ammine sono un gruppo funzionale speciale nei prodotti chimici organici costituito da un azoto caratteristico. Le ammine sono classificate come azoto attaccato ad una catena di carbonio. Allo stesso modo, a seconda di quanti atomi di carbonio sono presenti, possono anche avere attaccati idrogeni. Le ammine sono considerate primarie, secondarie o terziarie, a seconda che abbiano rispettivamente uno, due o tre atomi di carbonio attaccati.
Articoli correlati
- Georgia Banana Spiders: quanto diventano grandi?
- Le pulci di sabbia sono commestibili? Li mangeresti?
- Scopri i 5 migliori luoghi di viaggio per anziani in California
- Vipera cornuta
- I 12 acquari più grandi degli Stati Uniti
Inoltre, le ammine non sono vincolate alle catene di carbonio, poiché possono trovarsi anche all’interno degli anelli di carbonio o addirittura attaccate all’anello come gruppo laterale. Similmente all’ossigeno e all’idrogeno, l’azoto nelle ammine può presentare una certa polarità. Tieni presente che, a causa dell’elettronegatività, non è forte quanto l’attrazione polare in un composto ossigenato come l’acqua. Inoltre, le ammine possono legarsi con un massimo di tre molecole. Lasciano sempre una coppia solitaria di elettroni in uno dei loro orbitali.
Reattività amminica

©Elzbieta Krzysztof/Shutterstock.com
Come accennato in precedenza, le ammine mostrano una certa polarità, che può formare legami e reazioni deboli. Queste forze attrattive tra le molecole senza la formazione di veri legami sono chiamate forze intermolecolari.
Nel caso delle ammine, queste forze possono assumere la forma di dipolo-dipolo e ione-dipolo. In altre parole, il gruppo alquanto polare dell’azoto può interagire con altre molecole polari o con ioni come i sali. Inoltre, a seconda della dimensione dell’ammina, può anche avere interazioni di forza di dispersione, che aumentano con la dimensione molecolare e l’area superficiale.
Un’altra importante nota reattiva sulle ammine ha a che fare con la chimica degli acidi e delle basi. La coppia solitaria di elettroni trasportati dalle ammine le rende basi decenti. Quando interagiscono con acidi che contengono idrogeni, la coppia solitaria può strapparli via. Detto questo, le ammine sono ancora basi molto deboli, il che significa che hanno un limite alla loro reattività.
Produzione di ammine
Anche se le ammine sono ampiamente presenti in natura, ci sono alcuni chimici che hanno escogitato modi per produrle in laboratorio. Come probabilmente puoi immaginare, per creare un’ammina, devi attaccare una sorta di gruppo azotato a una sorta di catena di carbonio. La chimica di base delle ammine può aiutare in questo processo, poiché reagiscono facilmente con gli acidi, che spesso sono costituiti da gruppi di carbonio. Pertanto, il modo più comune in cui si formano le ammine è attraverso la reazione tra ammoniaca e un acido. Queste reazioni vengono spesso eseguite a fuoco elevato per ridurre la formazione di acqua. Anche i catalizzatori metallici sono comuni in queste reazioni.
Ammine presenti in natura
Le ammine sono estremamente comuni in natura, in particolare nel regno vegetale. Compongono un’ampia varietà di molecole naturali, la maggior parte delle quali sono descritte come alcaloidi. Ad esempio, gli alcaloidi vegetali possono funzionare nel mantenimento e nella difesa cellulare e persino nella produzione di pigmenti. Gli esseri umani possono persino ricavare alcaloidi dalle piante da utilizzare in prodotti come i medicinali. Alcune ammine si possono trovare anche nei sistemi animali, sebbene si ritenga solitamente che la loro funzione sia più generalizzata nel mantenimento delle cellule.
Oltre a queste funzioni, le ammine svolgono anche un ruolo importante in molti processi naturali. Ad esempio, molti neurotrasmettitori animali sono costituiti da gruppi amminici, che a volte funzionano nella loro capacità di segnalazione. In altre parole, le qualità delle ammine consentono loro di esibirsi in varie reazioni che si verificano naturalmente.
Cosa sono le ammidi?

©Mr.Yankittaphak Phoyalo/Shutterstock.com
Rispetto alle ammine, le ammidi sono leggermente più complicate nella struttura e nella natura. Per una regola generale, le ammidi sono solitamente derivate dalle ammine. Questo può aiutarti a ricordare che la cosa in comune tra loro è l’azoto, poiché è tutto ciò che un’ammina ha da offrire in una reazione. La cosa principale che separa le ammidi dalle ammidi è la presenza di un gruppo carbonilico. Se non hai molta familiarità con i gruppi carbonilici, sono caratterizzati dal doppio legame di un ossigeno con un carbonio. Si possono trovare comunemente nelle catene di carbonio o in altri gruppi funzionali come gli acidi carbossilici. A causa della presenza sia di un gruppo carbonilico che di azoto, le ammidi sembrano un ibrido tra acidi carbossilici e ammine.
Reattività ammidica
Proprio come le ammine, le ammidi hanno una discreta polarità dovuta alla presenza di atomi elettronegativi di azoto e ossigeno. Ciò significa che interagiranno con ioni e molecole polari e si dissolveranno facilmente in solventi polari come l’acqua. Proprio come le ammine, esibiscono forze intermolecolari simili, come le interazioni ione-dipolo e dipolo-dipolo. Inoltre, mostreranno anche alcune interazioni di forza di dispersione, soprattutto se fanno parte di molecole di grandi dimensioni. In sostanza, le forze intermolecolari di un’ammina e di un’ammide sono relativamente simili.
Anche in termini di reattività si collocano tra le ammine e gli acidi carbossilici. In altre parole, a loro non piace agire come basi. Inoltre non cedono gli atomi di idrogeno con la stessa facilità degli acidi carbossilici. Ciò li rende utili per applicazioni chimiche specifiche, come la creazione di farmaci ionizzati destinati a dissolversi facilmente in solventi naturali.
Produzione di ammidi
Come accennato, le ammidi possono essere prodotte con le ammine come reagente. Esistono due metodi principali con cui vengono prodotte le ammidi. Il primo prevede l’aggiunta di un acido carbossilico e di un gruppo amminico. Questo di solito richiede anche altri solventi per facilitare la reazione correttamente. Inoltre, le ammine possono essere prodotte anche mediante l’aggiunta di un cloruro acilico con un gruppo amminico. Alla fine, pensare ai singoli componenti che formano le ammidi può aiutare a capire cosa è necessario per produrle!
Ammidi presenti in natura
Simili alle ammine, anche le ammidi sono molto comuni nei sistemi biologici. Ad esempio, possono costituire la base di molte molecole conosciute, come la vitamina B. Allo stesso modo, sono comunemente usati negli animali per deviare i rifiuti azotati dal corpo sotto forma di urea.
Oltre a queste nuove molecole, le ammidi sono simili alle ammine nel fatto che possono anche formare molecole che svolgono importanti funzioni naturali. Oltre ai neurotrasmettitori, le ammidi possono anche far parte di altri segnali, come l’adrenalina e l’istamina.
Ammina vs Ammide
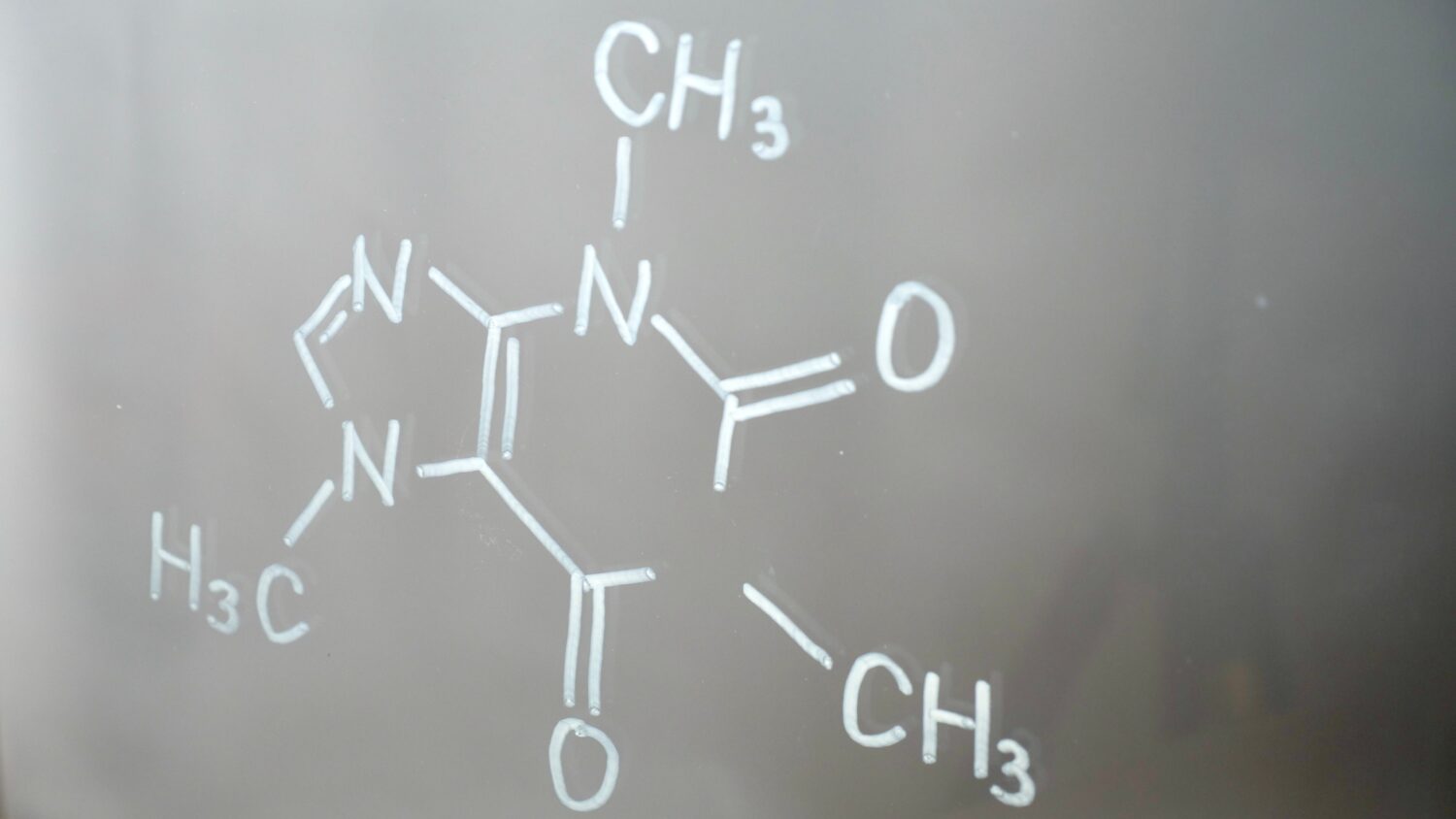
©OksanaFedorchuk/Shutterstock.com
Come probabilmente avrai capito da questo articolo, ci sono molte differenze utili da comprendere tra ammine e ammidi. Per riassumere, dai un’occhiata ai punti elenco sotto che elencano le principali differenze tra un’ammina e un’ammide.
- Le ammine si formano dalla presenza di azoto, mentre le ammidi richiedono la presenza aggiuntiva di un gruppo carbonilico attaccato
- Le ammine possono funzionare come basi deboli e derivano dall’ammoniaca.
- Le ammidi possono funzionare come acidi estremamente deboli e derivano da ammine e acidi.
Categoria: News

